聯系人:陳經理
電話:0371-67715372
郵箱:zzsy371@163.com
地址:鄭州市嵩山北路222號天龍大廈15層1505A
抗核抗體(antinuclear antibodies,ANA)是自身免疫病(autoimmune diseases,AID)重要的血清自身抗體,ANA的檢測結果對AID的診療及病情評估具有重要作用。ANA是以真核細胞各種成分為靶抗原的非器官特異性自身抗體。自1957年采用間接免疫熒光(indirect immunofluorescence,IIF)法檢測ANA以來[1],ANA的概念已經使用50余年。隨著免疫熒光抗體技術的改進及人源培養細胞抗原基質的廣泛應用,目前對ANA靶抗原的理解已由傳統的細胞核成分擴展到包括細胞核、細胞漿、細胞骨架、細胞分裂周期蛋白等[2,3]的整個細胞。ANA常用的檢測方法包括使用純化或重組抗原建立的ANA篩查方法,如ELISA和以HEp-2細胞為基質的IIF法等。前者具有操作簡單、可實現自動化等優點,但是使用純化或重組抗原檢測ANA總抗體,存在純化抗原過程中的抗原性"減弱"或"失活",或重組抗原的決定簇缺乏部分天然的高級結構及無法完全重組全部抗原成分而導致假陰性等缺點。后者由于HEp-2細胞具有人源性、核抗原種類豐富、特異性強、含量高、核大、細胞結構清晰、易于結果觀察及熒光染色模型分析,以及可以檢測ANA總抗體,因此以HEp-2細胞為基質的IIF法仍然被美國風濕病學會(American College of Rheumatology,ACR)、歐洲自身免疫標準化促進會(European Autoimmunity Standardization Initiative,EASI)等專業學會推薦為ANA檢測的"參考方法"。
一、抗核抗體HEp-2細胞間接免疫熒光模型命名
國內關于ANA HEp-2細胞間接免疫熒光模型介紹的專業圖譜書籍較少,目前廣泛使用的兩本圖譜分別為2000年馬東來主編的《自身抗體及免疫熒光模式》[4]和2014年李永哲主編的《自身抗體免疫熒光圖譜》[5]。ANA HEp-2細胞間接免疫熒光模型復雜,各國學者多年來不斷致力于規范各種熒光模型名稱。2014年8月28日在巴西圣保羅舉行的第12屆國際自身抗體和自身免疫研討會上,由來自15個國家的研究機構、臨床醫生和診斷實驗室的66位專家經過為期1 d的研討,形成ANA HEp-2細胞間接免疫熒光染色模型命名標準化國際共識[6]。該國際共識中將ANA HEp-2細胞間接免疫熒光染色模型分為3類:細胞核熒光模型、細胞漿熒光模型和細胞有絲分裂熒光模型,同時定義了每種熒光模型,并對鑒定要點進行了詳細描述。ANA HEp-2細胞間接免疫熒光染色模型命名:所有HEp-2細胞間接免疫熒光染色模型都賦予一個唯一AC(anti-cell)開頭的編碼,并登記于ANA熒光模型國際共識(international consensus on antinuclear antibody pattern,ICAP)網站(www.ANApatterns.org),見圖1。ANA HEp-2細胞間接免疫熒光染色模型結果回報:雖然目前絕大多數的ANA IIF檢測試劑都采用HEp-2細胞作為檢測基質,但是個別ANA HEp-2細胞間接免疫熒光染色模型在不同廠家檢測試劑上呈現的熒光模型仍有差別,如棒環狀熒光模型(rods and rings,RR),見圖2。鑒于此,并基于2014年的ANA HEp-2細胞檢測巴西指南[7],該指南為確保具有重要臨床意義的熒光模型被準確識別,根據熒光模型鑒別難易程度不同,將ANA熒光模型分為必報熒光模型(基礎水平報告熒光模型)和選報熒光模型(專家級水平報告熒光模型)。該共識明確指出目前設置的2大類熒光模型報告等級是暫時的,并且建議具有相應能力的自身抗體檢測實驗室人員盡量報告專家級水平熒光模型。

圖1
抗核抗體HEp-2細胞間接免疫熒光染色模型分類及命名[6]
二、細胞核熒光模型
細胞核熒光模型是指HEp-2細胞在分裂間期細胞核熒光染色所顯現的熒光形態,共包括7種主要核型和12種亞核型,見圖1。臨床診療日常工作中,必報熒光核型包括:均質型(AC-1)、斑點型(AC-2,4,5)、致密斑點型(AC-2)、著絲點型(AC-3)、核點型(AC-6,7)和核仁型(AC8,9,10);專家級選報熒光模型包括:核膜型(AC-11,12)、抗增殖細胞核抗原型(PCNA型AC-13)及著絲點-F型(AC-14)。
1.均質型:
分裂間期HEp-2細胞核漿呈均勻熒光染色,通常細胞核仁區熒光染色強度與細胞核漿其他區域一致,或者細胞核仁區無熒光染色。當標本中抗體濃度過高時,部分標本可見分裂間期HEp-2細胞核膜內緣熒光染色加強,產生周邊型熒光染色。分裂期HEp-2細胞的濃縮染色體呈均勻著染,染色體區外周細胞核漿熒光染色陰性。分裂間期或者分裂期HEp-2細胞漿無熒光染色。均質型對應的靶抗原主要為染色體成分,如抗雙鏈DNA(double stranded DNA, ds-DNA)抗體、組蛋白、核小體等,與致密斑點型的臨床意義完全不同,為了避免誤導臨床醫生,在臨床診療工作中鑒別兩種熒光模型分別報告非常重要。
2.斑點型:
分裂間期HEp-2細胞核漿呈細顆粒、粗顆粒或大顆粒型熒光染色,核仁區陰性或者部分熒光著染[例如存在抗干燥綜合征抗原B (Sjogren's syndrome antigen B, SS-B)抗體或抗Ku抗體時];分裂期HEp-2細胞的濃縮染色體無熒光染色,染色體區外可顯示顆粒型熒光染色。致密斑點型分裂間期HEp-2細胞核漿呈現細顆粒型致密的熒光染色,分裂期HEp-2細胞濃縮的染色體區為強的顆粒狀熒光染色,染色體區域外為陰性。此熒光核型見于抗致密細顆粒-70抗體,其靶抗原為晶狀體上皮細胞衍生生長因子和(或)DNA結合轉錄共激活因子p75,該抗體可見于各種AID、慢性感染性疾病、慢性疲勞綜合征及健康人群。
3.著絲點型:
分裂間期HEp-2細胞核漿呈現大小一致、明亮的點狀熒光均勻散布于細胞核,數量一般為40~60個,核仁常無熒光染色,有時也可見點狀熒光聚集于核仁區域。分裂期HEp-2細胞點狀或顆粒狀熒光集中于濃縮的染色體區,呈現"棒狀"或"帶狀"熒光染色。此熒光模型的靶抗原主要針對著絲粒染色體相關蛋白。
4.核多點型:
分裂間期HEp-2細胞核漿常呈現6~20個(平均10個)分散大小不一的點狀熒光染色,核仁不染色。分裂期HEp-2細胞濃縮的染色體區陰性,但在染色體以外的范圍有時可見散在的顆粒熒光。其相關靶抗原包括PML、Sp100及MJ/NXP-2。
5.核少點型:
分裂間期HEp-2細胞核漿常呈現1~6個點狀熒光染色,常靠近核仁區。分裂期HEp-2細胞濃縮的染色體區陰性。其相關靶抗原包括p80-螺旋蛋白和運動神經元生存蛋白。
6.細胞核核仁型:
主要指分裂間期HEp-2細胞的核仁熒光染色模型,該類熒光模型也屬必報熒光模型。在有經驗的自身抗體檢測實驗室,核仁型可進一步報告為核仁均質型、核仁斑片型和核仁顆粒型。核仁均質型為分裂間期HEp-2細胞整個核仁呈現均勻熒光染色,核漿可有相對較弱的彌漫性熒光染色;分裂期HEp-2細胞濃縮的染色體區陰性,在染色體區外圍可呈現彌漫性熒光染色。核仁斑片型,分裂間期HEp-2細胞核仁呈現明亮大顆粒熒光染色,常融合成片狀,細胞核漿無熒光染色;分裂期HEp-2細胞濃縮的染色體陰性,染色體外圍呈不規則環狀熒光染色。核仁顆粒型,分裂間期HEp-2細胞核仁呈現點狀熒光染色,核漿無熒光染色;分裂期HEp-2細胞濃縮的染色體區陰性,核仁形成區可見明亮的點狀熒光,胞漿可呈現弱的彌漫性熒光染色。
7.細胞核膜型:
分裂間期HEp-2細胞的核膜呈現光滑核膜型或點狀核膜型,而分裂中期赤道板無熒光,不同的熒光模型針對不同的特異性自身抗體及具有不同的臨床意義。
8.多形性熒光模型:
主要包括抗增殖細胞核抗原型(proliferating cell nuclear antigen,PCNA型)和著絲點-F型。PCNA熒光模型的特點是在HEp-2細胞核漿中見大小不一的斑點型熒光,在S期HEp-2細胞核漿中見熒光強度和顆粒最大的熒光染色,在S期的后期和G2期的早期,熒光斑點逐漸稀疏,核仁可呈熒光染色。G1期細胞和中期細胞通常不染色。著絲點-F型,分裂間期HEp-2細胞核漿中呈現細顆粒狀熒光染色,核仁無熒光染色。G2期為強的熒光染色,而G1期無熒光染色或弱的熒光強度。著絲粒染色僅出現在前中期和中期HEp-2細胞,呈現多個對齊的小、弱的點狀熒光。前中期細胞的細胞核膜常呈現較弱的熒光染色。分裂期HEp-2細胞漿周圍為典型的彌漫性熒光染色。而部分著絲點F型也可見中間體熒光染色。
三、細胞漿熒光模型
細胞漿熒光模型主要包括5大類:胞漿纖維型、胞漿顆粒型、線粒體型、高爾基體型和棒環狀熒光模型。這5大類核型被認為是臨床診療日常工作中必須報告的熒光模型,每大類所包含的具體熒光模型可由有經驗的自身抗體檢測實驗室選擇報告。
1.胞漿纖維型:
包括線狀、絲狀及片段狀熒光模型。胞漿線狀纖維型熒光模型的特征是HEp-2細胞骨架纖維,部分有小的、不連續的顆粒狀沉淀的熒光染色,其主要的靶抗原為位于細胞長軸方向的橫紋肌肌動蛋白。胞漿絲狀纖維型熒光模型為核膜擴散出的細絲和纖維,通常集中于細胞核周邊并擴展到細胞漿,其主要的靶抗原為波形蛋白和細胞角蛋白。片段狀胞漿纖維型熒光模型為沿應力纖維呈小片段、規律分布的致密性熒光增強小體,其主要的靶抗原包括α-輔肌動蛋白、紐蛋白和原肌球蛋白。
2.胞漿顆粒型:
包括胞漿散點型、胞漿致密顆粒型和胞漿細顆粒型。胞漿散點型為分裂間期HEp-2細胞漿呈現大小不等、數量及分布不均的明顯顆粒狀熒光染色,靶抗原包括甘氨酸/色氨酸(glycine-and tryptophan,GW)體、溶酶體、早期內涵體抗原1及胞漿聯接蛋白等。胞漿致密顆粒型為分裂間期HEp-2細胞漿呈現接近均質型的致密細顆粒型熒光染色,靶抗原包括蘇氨酰-tRNA合成酶、丙氨酰-tRNA合成酶和核糖體P蛋白等。胞漿細顆粒型為分裂間期HEp-2細胞漿呈現細顆粒型熒光染色,靶抗原包括組氨酰轉移核糖核酸(transfer RNA,tRNA)合成酶等。
3.線粒體型:
分裂間期HEp-2細胞漿呈現從細胞核邊緣延伸至整個細胞漿的不規則粗顆粒網狀熒光,細胞核和核仁陰性。強陽性時可導致細胞核呈顆粒狀熒光染色。分裂期HEp-2細胞濃縮的染色體區陰性,染色體周圍呈致密的粗顆粒樣熒光染色。
4.高爾基體型:
分裂間期HEp-2細胞漿毗鄰細胞核的一端或者圍繞核周呈現大小不均的顆粒型熒光染色。靶抗原高爾基-95/GW130、高爾基-97、高爾基-160和高爾基-245等。
5.棒環狀熒光模型:
分裂間期HEp-2細胞漿毗鄰細胞核的一端呈現圓環狀(直徑2~5 mm)或者棒狀(長度3~10 mm)熒光染色,其主要的靶抗原為次黃嘌呤5'磷酸鹽脫氫酶2。
四、細胞有絲分裂期熒光模型
細胞有絲分裂期熒光模型指與細胞有絲分裂密切相關的熒光染色模型。主要包括中心體型、紡錘體纖維型、分離帶型和染色體型。
1.中心體型:
分裂中期HEp-2細胞染色體區兩極(紡綞體頂部位置)呈現明亮的圓點狀熒光染色,有絲分裂后期兩個熒光亮點位于細胞的兩端,分裂間期HEp-2細胞漿常呈現單個圓點狀熒光染色,熒光圓點靠近核膜。其靶抗原包括多種成分,如烯醇化酶、中心粒周圍蛋白、中心體相關蛋白(centrosome-associated protein,Cep)250、Cep110等。
2.紡錘體纖維型:
分裂期HEp-2細胞紡錘體兩極間呈現纖維絲狀熒光染色,特別是中期細胞呈現明亮、完整的紡錘體纖維絲狀熒光,分裂末期細胞間橋的邊緣有熒光染色,部分中間體區域可見熒光,分裂間期細胞常無熒光染色。靶抗原包括相對分子質量130 000驅動蛋白相關蛋白,參與有絲分裂微管組裝的驅動蛋白樣蛋白。細胞核有絲分裂復合物熒光模型是紡錘體纖維型的一種亞型。在分裂間期HEp-2細胞核漿呈現明亮的致密細顆粒斑點型,核仁無熒光染色;分裂中期和后期在紡錘體兩極及紡錘體纖維的近端部分呈現出強的熒光染色,也被描述為三角形或香蕉形的熒光染色;分裂末期HEp-2細胞間橋無熒光染色。靶抗原為相對分子質量210 000的親中心體蛋白。
3.細胞橋聯型:
受細胞分裂周期影響該核型熒光表現各異,核分裂末期和胞質分裂期熒光位于分裂溝、收縮環、中間體和干體區。盡管在分裂間期熒光表現各異,但在前期和中期熒光表現為,染色體區垂直于赤道板的細拉鏈條索狀熒光,在分裂末期,通常表現為兩子代細胞交界處分裂溝的兩個局限性亮點。在S期和G2期可表現為散在不均的核斑點狀熒光。中間體是指胞核分裂期兩子代細胞分離時形成的有絲分裂區域,分裂后期中心紡錘體和分裂末期中間區域。此共識中推薦的中間體型專指細胞中間體著色,即細胞橋聯中間部分著色。中間體由150多種結構蛋白和動力蛋白組成。肌動蛋白14抗體熒光模型表現為中間體和中間帶特異性熒光。中間體中心可見隆起的干體。盡管靶抗原尚未完全確認,但促使著絲粒黏附于紡錘體的Aurora激酶B,可能會是其中一種抗原。其他的分子,比如著絲粒蛋白E(centromere protein E,CENP-E)、裂殖子表面抗原2(merozoite surface antigen 2,MSA-2)、驅動蛋白樣蛋白14,有絲分裂驅動蛋白樣蛋白1據報道也可能是中間體蛋白。
4.染色體型:
分裂前期和中期HEp-2細胞濃縮染色體呈現細顆粒狀熒光染色,濃縮染色體內和分裂間期細胞核漿無熒光染色[8]。但是,該型抗原及臨床意義并未見報道。
五、抗核抗體HEp-2細胞間接免疫熒光檢測結果報告
在2014年8月28日巴西圣保羅舉行第一屆ANA ICAP的基礎上,2015年在德國德累斯頓舉行了第二屆ICAP大會。本次會議討論了ANA在AID診療中的重要性,并形成了ANA檢測結果報告共識[9]。在第二屆ICAP大會ANA結果報告共識形成過程中,充分討論并形成了2種可供自身抗體檢測實驗室選擇的ANA結果報告形式。2種ANA結果報告形式都認為一份完整的ANA結果報告應該包括:ANA的檢測方法、定性結果、ANA核型和滴度(采用IIF)以及對臨床醫生的相關建議。2種ANA結果報告形式的區別在于,其中一種將HEp-2細胞胞漿熒光模型及細胞有絲分裂期熒光模型納入ANA陽性結果,而另一種將HEp-2細胞胞漿熒光模型及細胞有絲分裂期熒光模型納入ANA陰性結果。ANA檢測結果報告共識中建議的ANA檢測結果報告范例見表1。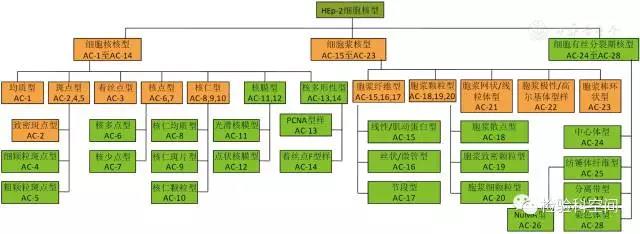
表1 ANA檢測結果報告范例[9] |
首先,ANA的檢測報告中應明確標明ANA的檢測方法,如HEp-2細胞IIF法,或者其他檢測方法如ELISA、熒光免疫微球等;由于不同試劑廠家提供的熒光檢測試劑可能影響不同的熒光模型,有條件的實驗室可以同時注明檢測方法對應的試劑廠家。其次,ANA的檢測報告中應明確標明ANA的定性結果(陽性或者陰性),采用IIF法的ANA結果隨后應標明熒光模型和滴度或者熒光強度(采用熒光自動判讀儀器時);采用ELISA等其他檢測方法的ANA結果隨后應標明檢測結果的定量數值。對于采用IIF檢測ANA結果如果遇到混合核型時,核型的報告優先級順序為細胞核熒光模型、細胞漿熒光模型、細胞有絲分裂期熒光模型。相同優先級的熒光模型,按滴度高低順序依次報告。第三,該共識推薦在ANA的檢測報告中應注明相關臨床建議。
六、討論
ANA HEp-2細胞間接免疫熒光染色模型命名標準化國際共識將ANA熒光模型分為必報熒光模型(基礎水平報告熒光模型)和選報熒光模型(專家級水平報告熒光模型)的逐級報告模式是比較合理和實用的。對于國內自身抗體檢測實驗室人員,剛開展ANA-IIF檢測或者經驗不足的自身抗體檢測實驗室,可進行較低等級的ANA熒光模型報告。對于經驗豐富的自身抗體檢測實驗室,為了給臨床醫生提供更豐富的檢測信息,非常有必要進行更詳細的ANA熒光模型報告,而不能僅停留于如細胞核斑點型或者細胞胞漿型的核型大類報告。值得國內自身抗體檢測實驗室人員重視的是ANA HEp-2細胞間接免疫熒光染色模型命名標準化國際共識中將細胞核致密斑點型(dense fine speckled,DFS)作為必報熒光模型,而國內自身抗體檢測實驗室人員對該熒光模型認識嚴重不足,常將DFS作為細胞核均質型或者細胞核斑點型報告。隨著對DFS的認識不斷深入,DFS的臨床意義與細胞核均質型或者細胞核斑點型完全不同,中高滴度的細胞核均質型或者細胞核斑點型提示自身免疫性疾病的可能性較大,而DFS并不作為自身免疫性疾病存在的標志。因此為了避免給臨床醫生帶來誤導,在臨床檢測工作中將該模型區別出來單獨報告具有重要意義。
基于目前國際上對ANA概念理解的不同(細胞漿熒光模型,細胞有絲分裂期熒光模型是否應該作為ANA陽性結果報告),以及現有各種AID診療指南中納入的ANA結果實質范疇,ICAP大會提出了2種可供自身抗體檢測實驗室選擇的ANA結果報告形式。一方面,我們需要認識到越來越多的學者將ANA的定義從針對細胞核成分的抗體擴展到針對整個細胞成分的抗體。而且無論是ACR還是EASI/國際免疫協會聯盟(International Union of Immunological Societies,IUIS)指南都接受除IIF法以外的其他方法如ELISA作為ANA檢測的備選方法,但是這些方法檢測ANA時,都會包含針對細胞漿成分的抗體,如組氨酰tRNA合成酶抗原(Jo-1 antigen,Jo-1)、核糖體P蛋白等,因此基于IIF法與這些備選方法檢測結果的一致性,應該將IIF法檢測ANA時的細胞漿熒光模型和細胞有絲分裂期熒光模型作為ANA陽性結果報告。另一方面,由于ANA的傳統定義只將ANA定義為針對細胞核成分的抗體,所以目前納入系統性紅斑狼瘡[10,11]、干燥綜合征[12]、混合型結締組織病[13]、系統性硬化癥[14]和自身免疫性肝炎[15]等許多AID疾病診斷指南中的ANA不包括細胞漿熒光模型和細胞有絲分裂期熒光模型,因此基于目前的疾病診療指南,如果將細胞漿熒光模型和細胞有絲分裂期熒光模型納入到ANA陽性結果,可能會影響到相關疾病診療指南的臨床應用。如在AIH的診斷標準評分體系中,ANA陽性根據不同滴度可獲得1~3分,而細胞漿熒光模型的抗線粒體抗體陽性則會減去4分,因此在此類疾病診療指南中,將細胞漿熒光模型和細胞有絲分裂期熒光模型作為ANA陽性結果報告勢必影響到相關指南的臨床應用。此外,一些全球性的室間質評系統中仍將細胞漿熒光模型和細胞有絲分裂期熒光模型作為ANA陰性結果處理,如英國國家室間質評服務(United Kingdom National External Quality Assessment Service,UK-NEQAS)。因此,基于上述存在的問題,目前的ANA結果報告國際共識推薦2種形式。如果將來ANA結果報告中細胞漿熒光模型和細胞有絲分裂期熒光模型作為ANA陽性結果報告達到國際共識,必將引起一些現有的室間質評評分系統和AID疾病的診療指南的修改和更新。
ANA檢測結果報告共識建議ANA檢測結果報告應注明相關臨床建議。國內自身抗體檢測工作者在臨床實踐工作中常疏忽了這方面。由于針對特異性靶抗原對應的自身抗體是診斷自身免疫病的重要依據,因此在熒光模型中如果高度懷疑存在針對某個疾病特異性靶抗原的自身抗體存在時,應建議臨床醫生進一步進行該特異性抗體的檢測。ANA檢測結果報告中注明重要臨床建議有助于臨床醫生及時準確地提出下一步檢測需求,有助于患者疾病的及時正確診斷和治療。
ANA的滴度是ANA檢測結果的重要組成部分,對臨床疾病診斷和病情評估有重要價值。在本共識解讀成文及審稿過程中也有許多專家提及ANA滴度的重要性。由于ANA檢測的滴度問題非常復雜,在ANA報告國際共識中僅提及需要報告滴度,但并未對怎樣報告滴度,采用何種滴度系統(傳統倍比稀釋系統或者10開方的稀釋系統)進行詳細明確闡述。在我國,ANA檢測的滴度問題實際情況更為復雜:(1)采用傳統倍比稀釋系統試劑,倍比稀釋系統報告滴度;(2)采用10開方的稀釋系統試劑,倍比稀釋系統報告滴度;(3)10開方的稀釋系統試劑,10開方的稀釋系統報告滴度。我們期待在后續的相關專家述評或者將來建立該領域國內共識的時候將ANA滴度實驗的建立、質控及稀釋原則等重要臨床問題進行詳細討論并逐一明確。
隨著對ANA臨床意義的認識不斷深入,越來越多的臨床工作者重視ANA檢測,ANA檢測的方法和結果報告的形式將在國際范圍內逐步規范[16],該舉措必將進一步促進ANA檢測質量的提高和充分發揮ANA在AID臨床診療中的價值。